Absorption et digestion des lipides
Lipides et exercice physique
Son excellence le cholestérol
CHOLESTÉROL
Le cholestérol n’est ni bon, ni mauvais, il est indispensable !
Cette histoire farfelue a empoisonné la vie de millions de patients pendant des dizaines d’années avec pour seul véritable bénéfice l’engraissement des laboratoires pharmaceutiques.
Je dédie cet article à toutes les patients qui ont fait l’objet de prescriptions abusives de statines.
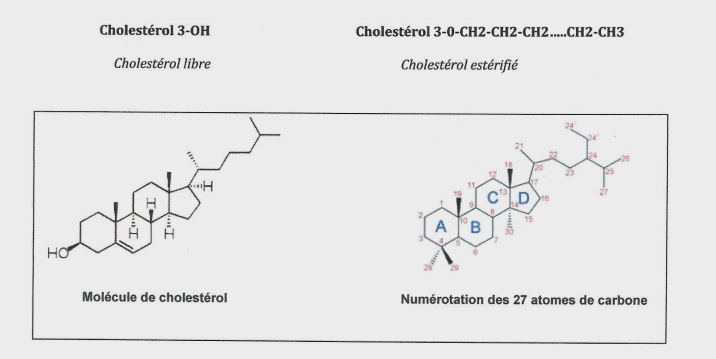
L’explication de ce paradoxe est simple, il n’existe qu’une seule et unique molécule de cholestérol.
Le cholestérol se trouve dans l’organisme sous forme de cholestérol libre (cellules) ou estérifié à un acide gras à longue chaîne (circulation sanguine).
Présent dans l’alimentation, le cholestérol peut être également synthétisé par de par le foie. Outre son rôle essentiel dans la participation à la structure membranaire, le cholestérol apparaît comme un carrefour métabolique, point de départ de nombreuses substances hormonales (aldostérone, corticostéroïdes, œstrogènes, androgène) vitaminique (vitamine D) ou digestive (sels biliaires).
APPORT EXOGENE DE CHOLESTEROL
= Le cholestérol dans l’alimentation
Le cholestérol est strictement d’origine animale.
Les végétaux possèdent une molécule assez proche appelée Phytostérol.
Stérols végétaux
Les stérols végétaux encore appelés phytostérols, se trouvent à l’état naturel, dans de nombreux végétaux, et plus particulièrement dans les céréales, les fruits et les légumes. Ils sont présents dans la partie lipidique des plantes. Au niveau de l’intestin, les stérols végétaux permettent de limiter l’absorption du cholestérol par effet de compétition. Les phytostérols, en freinant l’absorption du cholestérol, diminuent le taux sanguin de cholestérol après le repas, et uniquement après le repas.
NB : Les phytostérols perturbent également le cycle entéro-hépatique des sels biliaires (les sels biliaires sont moins bien réabsorbés). Ce phénomène a des répercussions sur la synthèse hépatique du cholestérol (augmentation).
Seulement 50% du cholestérol organique a pour origine l’alimentation.
Principales substances riches en cholestérol (>100 mg / 100 ml)
Foie, rognon, cervelle : 1500 à 2000 mg / 100 g
Jaune d’œuf : 1500 mg / 100 g
Beurre 250 mg / 100 g
Lard, saindoux, crème à 30%, fromage bleu, porc, canard, sardines 100 mg / 100 g
Produits contenant entre 50 et 99 mg / 100 g
Crème à 20%, fromages, agneau, bœuf, cheval, veau, lapin, poulet, poissons
Aliments pauvres en cholestérol
Yaourt (8 mg /100 g), lait demi-écrémé (9 mg), blanc d’œuf (0 mg), végétaux.
= Digestion et absorption du cholestérol
Le cholestérol présent dans l’intestin provient des substances ingérées mais aussi des sécrétions biliaires, il est sous forme libre ou estérifiée
Le cholestérol estérifié présent dans l’intestin, est hydrolysé en cholestérol libre par la cholestérol hydrolase sécrétée par le pancréas.
Le cholestérol libre est directement absorbé à travers la bordure en brosse. Dès sa pénétration cellulaire le cholestérol est à nouveau estérifié, puis incorporé aux chylomicrons, lipoprotéine de transport synthétisée par les entérocytes.
Il existe une compétition entre le cholestérol et les phytostérols, la présence de ces derniers limitant l’absorption du cholestérol*.
*A titre d’exemple, le canard consommé avec de l’orange ou des navets, apportera moins de cholestérol à l’organisme, qu’une part de canard cuisinée avec la même quantité de beurre, mais consommée seul.
Toutes les fibres alimentaires entravent gravement l’absorption des nutriments (sucres, acides aminés, vitamines, oligoéléments), et celle du cholestérol également.
Un excès de fibres constitue une hérésie nutritionnelle à l’origine de carences en vitamines et oligoéléments pouvant être gravissimes. C’est la pire des méthodes pour lutter contre l’hypercholestérolémie.
= Solubilisation et transport du cholestérol alimentaire
+ Solubilisation
Le cholestérol est insoluble dans le plasma, son transport nécessite de ce fait la présence de structures protéiques (lipoprotéines), les chylomicrons, synthétisées par l’intestin. Les chylomicrons ainsi appelés parce qu’ils véhiculent le cholestérol dans les vaisseaux lymphatiques avant de passer dans le plasma.
+ Synthèse des chylomicrons
Ils apparaissent dans le plasma environ une heure après la prise du repas. Leur synthèse, et donc leur concentration, est d’autant plus importante que le repas est riche en lipides.
Les chylomicrons sont chargés de cholestérol, des lipides ingérés et des sécrétions biliaires réabsorbées (cycle antéro-hépatique des sels biliaires). Les chylomicrons sont très riches en Apo B (23%), C3 (36%) et C1 +C2 (30%).
La fraction protéique (Apo B 48) est synthétisée dans le réticulum par les ribosomes. Elle est ensuite associée aux lipides dans le réticulum lisse avant d’être excrétée via l’appareil de Golgi.
Une fois dans la circulation les chylomicrons fixent à la périphérie de leur structure des apo-lipoprotéines E et C originaires des HDL.
+ Destinée des Chylomicrons
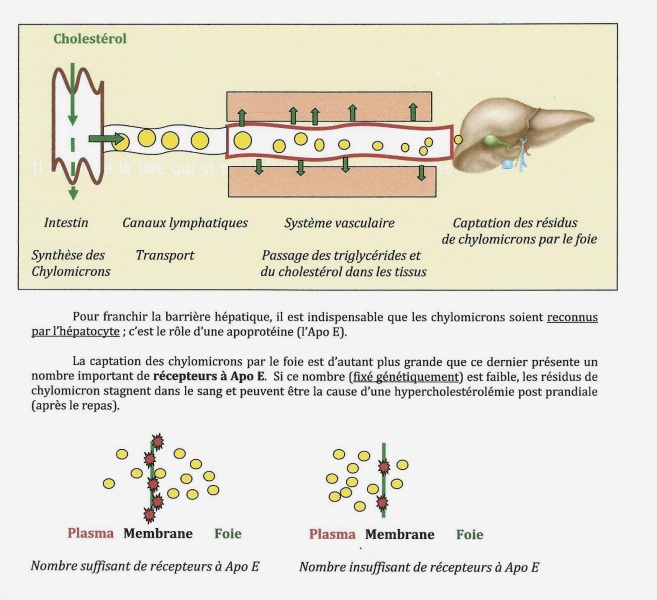
Grâce à l’Apo E fixée à leur périphérie, les chylomicrons sont « reconnus » par les cellules et peuvent ainsi délivrer une partie de leur contenu lipidique (cholestérol et triglycérides) aux tissus périphériques et sont finalement captés par le foie. Cet « amaigrissement » des chylomicrons aboutit à une diminution progressive de leur taille (ils prennent alors le nom de « résidus de chylomicrons » ou « chylomicrons remnants »).
Le foie possèdes récepteurs spécifiques à chylomicrons qui permettent leur captation par les hépatocytes. Dans les hépatocytes la fraction protéique est hydrolysée et les lipides, dont le cholestérol libérés. Il s’agit de cholestérol libre.Une fois entrés dans le foie les chylomicrons sont dégradés et le cholestérol hydrolysé sous forme libre.
Remarques : Il est clair que les régimes riches en cholestérol provoquent momentanément (avant la captation des chylomicrons par le foie, une hypercholestérolémie transitoire.
+ Chez l’individu sain, cette hypercholestérolémie passagère ne présente aucun caractère pathologique et ne nécessite aucun régime particulier.
+ A l’inverse chez les sujets porteurs d’un gène défectueux codant la synthèse des récepteurs à chylomicrons, l’hypercholestérolémie prolongée (le temps que tous les résidus de chylomicrons soient captés par le foie) peut être source de complications athéromateuses. C’est le seul type de pathologie nécessitant un régime très pauvre en cholestérol et en lipides. Le traitement consiste donc à limiter la synthèse des chylomicrons et donc leur temps de passage dans la circulation.
+ L’Apo E permet également à une autre lipoprotéine d’être reconnue par le foie (les IDL). Il existe donc en période post prandiale une compétition entre les IDL et les chylomicron. Ce mécanisme a pour effet de prolonger la présence des chylomicrons dans le sang et de freiner la captation des IDL, concourant ainsi à une hypercholestérolémie.
SYNTHESE HEPATIQUE DU CHOLESTEROL
Le cholestérol, qui peut théoriquement être synthétisé par un grand nombre de cellules, l’est essentiellement dans le foie à partir d’Acétyl Co Enzyme A (Acétyl CoA), molécule pouvant provenir de la dégradation des sucres et des lipides et d’un certain nombre d’acides aminés.
La synthèse du cholestérol représente environ 50% du cholestérol présent dans l’organisme.
=De l’Acétyl CoA au Mévalonate
L’acétyl CoA est l’élément de base de cette synthèse (en effet, les 27 atomes de carbone du cholestérol sont issus de cette molécule).
Thiolase
2 Acétyl CoA ——-Acéto-acétyl CoA
HMG CoA synthétase
Acéto-acétyl CoA + Acétyl CoA 3————- OH 3 méthylglutaryl CoA (HMG CoA)
H2O SH-CoA
Plusieurs étapes peuvent être distinguées, mais une seule réaction régule la synthèse du cholestérol.
La HMG CoA réductase est l’enzyme clé de la chaîne enzymatique.
HMG CoA réductase
HMG CoA———— Mévalonate + HS-CoA
2 NADPH2 2 NADP
Il s’agit de l’étape chargée de freiner ou d’accélérer la synthèse du cholestérol en fonction :
= Des concentrations locales de cholestérol libre et des sels biliaires
= De l’état hormonal général concernant le glucagon et insuline du sujet.
= De la présence locale des précurseurs métaboliques (Acétyl CoA)
= D’un environnement réducteur (NADPH2)
NB : Cette enzyme n’est pas sensible au taux sanguin de cholestérol. Elle pourra ainsi dans certaines conditions métaboliques se trouvée accélérée alors que le sujet est hypercholestérolémique+++++.
= Solubilisation et transport plasmatique
Le cholestérol est insoluble dans le plasma, son transport nécessite de ce fait la présence de structures protéiques (lipoprotéines) synthétisées par le foie ou l’intestin (chylomicrons). Les lipoprotéines assurent également la circulation des triglycérides (autres graisses insolubles dans le plasma).
+ Lipoprotéines
Le cholestérol est soumis à un turn over continuel entre le foie et les tissus.
En dehors des périodes de repas, le foie libère des lipoprotéines riches en cholestérol et triglycérides qui seront captés par les tissus périphériques. Le cholestérol sera utilisé pour la construction membranaire, et le métabolisme cellulaire, notamment en ce qui concerne les glandes endocrines utilisant le cholestérol comme précurseur métabolique.
Les lipoprotéines synthétisées dans le foie (VLDL, HDL) ou dans l’intestin (chylomicrons) sont constituées d’une partie protéique, les apolipoprotéines (Apo B48, Apo B100, Apo A) destinées à solubiliser les graisses et à assurer diverses fonctions métaboliques :
Apo D : échange de cholestérol entre HDL et les autres lipoprotéines
Apo C : activation des enzymes tissulaires
Apo E : essentielle dans la reconnaissance et la captation des IDL et des chylomicrons par le foie.
+ Circulation du cholestérol
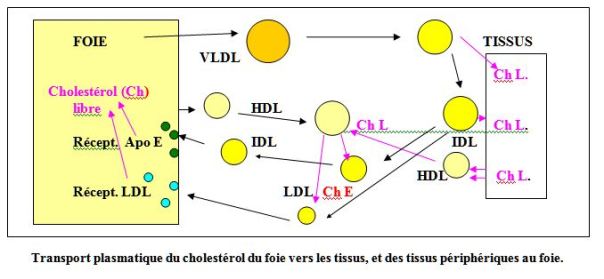
= Le cholestérol quitte le foie au sein des VLDL (lipoprotéines très légères). Ces dernières distribuent aux tissus périphériques leur contenu lipidique (cholestérol et triglycérides). Le cholestérol contenu dans les VLDL est sous forme estérifié, il est distribué aux tissus périphériques sous forme de cholestérol libre
= Ce phénomène est à l’origine d’un « amaigrissement » des VLDL qui se transforment en IDL (intermédiaires), puis en LDL (légères), qui regagnent le foie.
= Le chemin inverse, transport du cholestérol des tissus vers le foie est réalisé grâce aux HDL (lipoprotéines lourdes) qui captent le cholestérol libre des tissus par simple gradient de concentration (les tissues sont très riches en cholestérol libre par rapport aux HDL qui estérifient rapidement le cholestérol grâce à la LCAE activée par l’Apo C).
Le cholestérol estérifié est transféré aux IDL et aux LDL (action de l’Apo D) qui le rapporteront au foie.
Le bon cholestérol était censé correspondre à celui fixé sur les HDL (épuratrices des tissus dans la dialectique simpliste de ses afficionados), par opposition à celui incorporé dans les VLDL et les LDL (alors que ce sont ces dernières qui gagnent le foie). 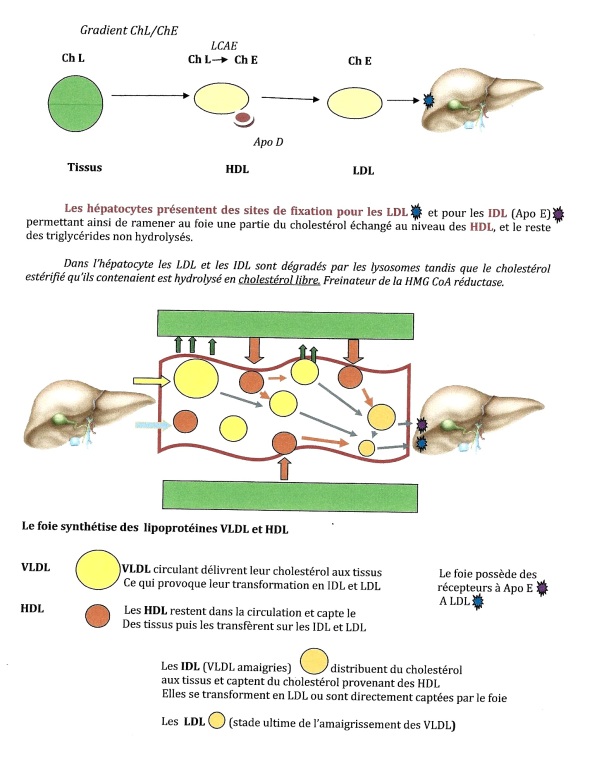 Il ne saurait être en outre être question « d’épuration » des tissus. Il s’agit d’un cycle biologique physiologique.
Il ne saurait être en outre être question « d’épuration » des tissus. Il s’agit d’un cycle biologique physiologique.
RÉGULATION DE LA SYNTHÈSE HÉPATHIQUE DU CHOLESTEROL
Quatre mécanismes agissent sur la synthèse hépatique du cholestérol:
= L’Inhibition de la synthèse par rétrocontrôle
= La régulation de la synthèse par les substrats
= La régulation covalente de la synthèse
= Régulation de la synthèse du cholestérol par les LDL
= Inhibition de la synthèse par rétrocontrôle
Toute augmentation de la concentration en cholestérol libre hépatocytaire freine l’HMG CoA réductase. Il s’agit d’un rétrocontrôle négatif.
Les sels biliaires, synthétisés à partir du cholestérol, jouent également un rôle inhibiteur de la synthèse. Si pour une raison pathologique (mal absorption) ou diététique (alimentation trop riche en fibres), le cycle entéro-hépatique des sels biliaires se trouve perturbé, la concentration des sels biliaire diminue et lève alors l’inhibition du rétrocontrôle.
INTERACTION AVEC L’ALIMENTATION
+ En l’absence de pathologie, un apport de cholestérol alimentaire important augmente la concentration en cholestérol libre hépatocytaire, et freine ainsi la synthèse.
+ Un apport excessif de fibres en limitant l’absorption du cholestérol alimentaire et en perturbant le cycle entéro-hépatique des sels biliaires augmente la synthèse. Dans ce cas l’organisme est capable de synthétiser 1 gramme de cholestérol / j.
De manière paradoxale, chez les adeptes inconditionnels de la consommation abusive des fibres alimentaires, la synthèse du cholestérol endogène de trouve donc désinhibée.
= Régulation de la synthèse par les substrats
Pour fonctionner à sa vitesse maximale, l’enzyme doit disposer de quantités suffisantes de substrats. La HMG CoA réductase dispose de deux substrats: l’AMG (condensation d’Acétyl CoA) et le NADPH2 (un donneur de proton).
= L’Acétyl CoA est produit en grande quantité par :
+ Une absorption répétée de sucres rapides.
+ La dégradation des acides gras saturés apportés au foie par les triglycérides
+ Le métabolisme de l’alcool.
= Le NADH2 et LE NADPH2, tous deux réducteurs proviennent également de la dégradation des acides gras pour les premiers et de la dégradation de l’alcool pour les seconds (alcool déshydrogénase).
L’apport excessif en triglycérides d’origine animale, de sucres rapides et l’abus de substances alcoolisées concourent ainsi à augmenter la synthèse de cholestérol.
= Régulation covalente de la synthèse
Il ne s’agit pas d’une régulation covalente stricto sensu puisqu’il n’existe qu’une seule voie métabolique (la synthèse), mais d’une régulation de type covalent puisque la HMG CoA réductase existe sous deux formes, active et inactive. Cette régulation est sous la dépendance de l’insuline et du glucagon.
= Le glucagon favorise la forme inactive de l’HMG Réductase. C’est l’hormone qui est sécrétée lors des phases de jeûne. Il est hypocholestérolémiant.
= L’insuline favorise la forme active de l’HMG CoA réductase. Elle est hyper-cholestérolémiante.
INTERACTION AVEC L’ALIMENTATION ET L’ACTIVITE PHYSIQUE
+ La sécrétion d’insuline est:
stimulée :
Lors des prises itératives de sucre (grignotage) ou d’alcool (éthylisme)
Lors des régimes hypercaloriques (obésité).
inhibée par :
Le jeûne
Les catécholamines sécrétée lors des exercices physiques
+ Le glucagon n’est sensible qu’au jeûne. Il augmente deux à quatre heures après le dernier repas (fonction de la composition du repas). Il n’est pas sensible à l’activité physique.
En conséquence, ce n’est pas en augmentant la part des fibres (céréales, pain complet et autres lests intestinaux que l’on peut régler le problème des décharges itératives d’insuline, mais en diminuant l’apport calorique global, en supprimant tout grignotage et en composant des repas équilibrés sans masochisme exagéré (un repas comprenant des graisses, des protéines, des sucres et quelques fibres peut figurer sur la carte d’un trois étoiles).
= Régulation de la synthèse du cholestérol par les LDL
Les membranes hépatocytaires présentent un nombre plus ou moins important de sites de reconnaissance pour les LDL et les IDL (Apo E).
La fixation de ces lipoprotéines sur ces sites permet de ramener vers le foie le cholestérol issu des tissus périphériques. Apporté sous forme estérifiée, le cholestérol est immédiatement hydrolysé en cholestérol libre. Le transfère du cholestérol des lipoprotéines plasmatiques vers le foie présente deux effets:
= Une augmentation de la concentration hépathocytaire en cholestérol libre inhibant la synthèse par rétrocontrôle.
= Une diminution de la cholestérolémie.
PATHOLOGIES
Il a été montré que l’hypercholestérolémie familiale avait pour origine un trouble génétique dont l’expression phénotypique était la moins grande densité (environ la moitié) de ces sites sur les hépatocytes.
Il existe trois types d’hypercholestérolémie familiale liée aux récepteurs :
Une insuffisance de récepteurs à LDL
Une insuffisance de récepteurs à Apo E
Une combinaison des deux
INTERACTION AVEC L’ALIMENTATION ET L’ACTIVITE PHYSIQUE
= Nombre des récepteurs à LDL et Apo E
Le nombre des récepteurs à Apo E disponibles est également fonction de la concentration plasmatique des chylomicrons. Toute augmentation des chylomicrons, par un apport lipidique alimentaire excessif (triglycérides d’origine animale), limite le nombre des sites régulateurs favorisant ainsi la stagnation des LDL dans le plasma et la baisse du cholestérol libre hépatocytaire (augmentation de la synthèse du cholestérol).
= Fonctionnalité des récepteurs
Les récepteurs à LDL et à Apo E présents dans la membrane hépatocytaire ne sont pas tous actifs (une partie d’entre eux sont trop loin de la membrane pour jouer leur rôle de capteur).
L’exercice physique est capable de modifier le nombre des récepteurs actifs (récepteurs accessibles aux LDL). Un exercice régulier et suffisamment intense pour provoquer la synthèse des catécholamines, augmente significativement le nombre des récepteurs et leur accessibilité. Pour cette raison l’exercice physique est un excellent hypocholestérolémiant.
= Lipoprotéines plasmatiques
Le taux des LDL est directement en relation avec la consommation d’acides gras saturés* et le pourcentage de masse grasse du sujet (Plus de LDL, c’est plus de cholestérol qui stagne dans la circulation). Ce mécanisme justifie pleinement la restriction en graisses d’origine animale. La quantité de cholestérol contenu dans ces graisses ne constitue pas « a contrario » un élément essentiel.
* Les acides gras insaturés sont essentiellement utilisés dans des filières non énergétiques.
L’exercice physique diminue la concentration plasmatique en LDL du fait d’un recyclage plus rapide par le foie (augmentation du nombre des récepteurs hépatiques actifs)
Le taux des HDL plasmatiques est d’autant plus important que la masse corporelle est faible. Il est diminué par la consommation d’alcool et les œstrogènes (contraceptifs oraux). L’exercice physique stimule la synthèse des HDL.
L’exercice physique augmente la synthèse des Apoprotéines A (HDL) et diminue sensiblement celle des Apoprotéines B, (VLDL, LDL).
REGULATION DE LA CHOLESTEROLEMIE
Au total, la cholestérolémie est donc régulée par de nombreux facteurs :
Augmentent la cholestérolémie Diminuent la cholestérolémie
Diététique Alcool, Acides gras saturés Acides gras poly insaturés en 3 et 6 Excès de fibres alimentaire
Hormonaux Insuline, oestrogènes Glucagon, catécholamines
Génétique Le faible nombre de récepteurs à HDL
La non reconnaissance de l’Apo E L’inverse
Hygiène de vie Tabac, sédentarité, obésité Exercice physique
RISQUE ATHEROGENE
L’athérome est un dépôt par accumulation de différents éléments (graisse, sang, tissu fibreux, dépôt calcaire) sur une partie de la paroi interne d’une artère, l’intima. Le diamètre de celle-ci diminue, ce qui peut entraver la circulation sanguine (diminution du calibre, agrégats plaquettaires)..
La plaque d’athérome se forme progressivement au niveau d’un dommage de la paroi artérielle ou d’une zone de turbulence (bifurcations artérielles).
Ce n’est en aucun cas le cholestérol qui se trouve à l’origine de l’atteinte artérielle mais un certains nombre de dysrégulations innées ou acquises (diabète, éthylisme, obésité, sédentarité, fragilité constitutionnelle, intoxication tabagique…). L’hypercholestérolémie n’est qu’un facteur aggravant.
Les calculs faisant état d’un risque athérogène sont globalement erronés, le simple rapport Apo A/Apo B ne prenant en compte qu’une très faible partie des paramètres en cause.
LES STATINES
Les statines constituent une famille thérapeutique qui agit en inhibant l’HMG CoA réductase, enzyme limitante pour la synthèse hépatique du cholestérol. Elles agissent de façon compétitive en se substituant à son substrat naturel, l’HMG CoA, au niveau du site catalytique de l’enzyme.
= Effets de L’inhibition
Les statines provoquent une diminution de la concentration intra hépatocytaire de cholestérol libre. Cette chute de concentration du cholestérol libre intra-hépatocytaire active les mécanismes moléculaires responsables de la sur-expression des récepteurs au LDL permettant l’augmentation de la capture des lipoprotéines (LDL, chylomicrons, IDL) par les hépatocytes.
La production de cholestérol se trouve ainsi freinée de même que la synthèse des VLDL (probablement du fait de la suppression de la synthèse de l’apolipoprotéine B ). Il en résulte une réduction de la concentration plasmatique des VLDL, des IDL et des LDL.
Parallèlement, l’augmentation de la capture des LDL, diminue la concentration plasmatique en cholestérol.
= Indications
Toutes les statines sont indiquées dans le traitement des hypercholestérolémies primaires ou des dyslipidémies mixtes en complément d’un régime alimentaire, lorsque la réponse au régime et aux autres traitements non pharmacologiques (exercice physique, perte de poids) s’avère insuffisante.
= Complications
Les atteintes musculaires et tendineuses provoquées par les statines sont dose-dépendantes et plus fréquentes en cas d’interaction médicamenteuse ou alimentaire (jus de pamplemousse ?) augmentant leur concentration. La physiopathologie est mal connue mais pourrait impliquer une toxicité mitochondriale due à la déplétion en mévalonate, précurseur du Co-enzyme Q, cofacteur de la chaîne respiratoire, une altération de la fluidité membranaire liée à la déplétion en cholestérol ou une apoptose des cellules musculaires. Cet effet secondaire est particulièrement préjudiciable à la mise en route d’une activité physique ; c’est pourquoi le programme physique doit toujours précéder la prise médicamenteuse au risque de se priver de ce précieux adjuvant.
C’est donc bien l’hygiène de vie qui est bonne ou mauvaise, jamais le cholestérol.